แบบจำลองอะตอม
แบบจำลองอะตอมของดอลตัน
แบบจำลองอะตอมของทอมสัน
แบบจำลองอะตอมของนีลส์โบร์
เรื่องเส้นสเปกตรัม
อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน
ในปีพ.ศ.2346 จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงมวลของสารก่อนและหลังทำปฏิกิริยาเคมี ซึ่งมีสาระสำคัญดังนี้
1.ธาตุประกอบด้วยอนุภาคเล็กๆ อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2.อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน เช่น มีมวลเท่ากัน แต่จะมีสมบัติแตกต่างกันจากอะตอมของธาตุอื่น
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
แบบจำลองอะตอมตามทฤษฎีดอลตัน
ทฤษฎีอะตอมของดอลตันช่วยให้นักวิทยาศาสตร์สามารถอธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง ต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้น และค้นพบว่ามีข้อมูลบางประการไม่สอดคล้องกับทฤษฎีอะตอมของดอลตัน เช่นพบว่าอะตอมของธาตุชนิดเดียวกันมีมวลแตกต่างกันได้ อะตอมสามารถแบ่งแยกได้ แนวคิดเกี่ยวกับทฤษฎีอะตอมของดอลตันจึงไม่ถูกต้อง
ในปลายคริสต์ศตวรรษที่ 19 ได้มีการค้นพบ
หลอดรังสีแคโทด
และในปี 1897 ได้มีผู้ทำการทดลองเกี่ยวกับ
แต่แบบจำลองอะตอมของ
แบบจำลองอะตอมของรัทเธอร์ฟอร์ด
เออร์เนสต์ รัทเธอร์ฟอร์ด (Ernest Rutherford) ได้ทำการ
จาก
1อิเล็กตรอน
2.อะตอมที่มีอิเล็กตรอนมาก
3.ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กัน
รูปแบบจำลองอะตอมของรัทเธอร์ฟอร์ด
แบบจำลองอะตอมของนีลส์โบร์
นีลส์โบร์ได้เสนอแบบจำลองอะตอม โดยอาศัยทฤษฎีของพลังค์และอัลเบิร์ตไอน์สไตน์ ที่เกี่ยวกับความสัมพันธ์ระหว่างพลังงานกับความถี่ของคลื่น ( ควอนตัม ) รวมทั้งความรู้เรื่องของเส้นสเปกตรัม
เรื่องเส้นสเปกตรัม
เมื่ออิเล็กตรอนได้รับพลังงาน จึงขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้น ทำให้อะตอมไม่เสถียร อิเล็กตรอนจึงคาย พลังงานเท่ากับพลังงานที่ได้รับเข้าไปพลังงานส่วนใหญ่ที่คายออกอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า ปรากฏเป็นเส้น สเปกตรัม 2. การเปลี่ยนระดับพลังงานของอิเล็กตรอน อาจมีการเปลี่ยนข้ามขั้นได้ 3. อิเล็กตรอนในระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียส 4. ระดับพลังงาต่ำอยู่ห่างกันมากกว่าระดับพลังงานสูง ระดับพลังงานยิ่งสูงขึ้นจะยิ่งอยู่ชิดกันมากขึ้น
สรุปแบบจำลองอะตอมของนีลส์โบร์
1.อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆตามระดับพลังงานและแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุด
ยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน
n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2 , n = 3,…….ตามลำดับ หรือเรียกเป็นชั้น K , L , M ,N ,O , P , Q ….
รูปแบบจำลองอะตอมของนีลโบร์
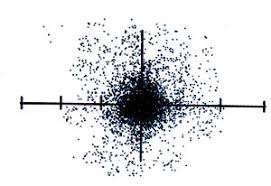
แบบจำลองอะตอมของกลุ่มหมอก
แบบจำลองอะตอมของกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่าอิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองนี้เชื่อว่า
1.อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียสเป็นรูปทรงต่างๆตามระดับพลังงาน
2.ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมากและเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3.อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบแสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
1.อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียสเป็นรูปทรงต่างๆตามระดับพลังงาน
2.ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมากและเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3.อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบแสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
อนุภาคในอะตอมและไอโซโทป
อนุภาคในอะตอม
ในปีพ.ศ.2451 รอเบิร์ต แอนดรูส์ มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยอาศัยการสังเกตหยดน้ำมันในสนามไฟฟ้า ดังรูป
เมื่อละอองน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้น ทำให้ละอองน้ำมันบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวก บางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าลบ และบางหยดลอยนิ่งอยู่ระหว่างสนามไฟฟ้า และจากความสัมพันธ์ของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้า ทำให้สามารถคำนวนค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่าของ1.6 x 10–19 คูลอมบ์ เมื่อนำมาคำนวนร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้มวลของอิเล็กตรอนเท่ากับ9.11 X 10-28 กรัม
ในปีพ.ศ.2429 ออยเกน โกลด์ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดและแอโนด ดังรูป
ในปี พ.ศ. 2475 เจมส์ แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงสูง ทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกอนุภาคนี้ว่า นิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอน การค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอม ซึ่งพบว่ามีค่ามากกว่ามวลรวมของโปรตอน เช่น ธาตุคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วย แต่มวลของอะตอมมีค่า 12 หน่วย และมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกัน ดังนั้น อิเล็กตรอน โปรตอน และนิวตรอน จึงเป็น อนุภาคในอะตอม ซึ่งอนุภาคแต่ละชนิดมีรายละเอียด ดังนี้
เลขอะตอม เลขมวล และ ไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอม และมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบนิวเคลียส อะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่น ตัวเลขที่แสดงจำนวนโปรตอนเรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมาก ดังนั้นมวลของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสที่ประกอบด้วยโปรตอนและนิวตรอน เรียกผลรวมของจำนวนโปรตอนและนิวตรอนว่า เลขมวล เช่น คาร์บอนมี 6 โปรตอนจึงมีเลขอะตอมเท่ากับ 6 โดยอาจมี 6 หรือ 7 นิวตรอน จึงมีเลขมวลเป็น 12 หรือ 13 ตามลำดับ
สัญลักษณ์ที่เขียนแสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุ เลขอะตอม และเลขมวลของอะตอม เรียกว่า สัญลักษณ์นิวเคลียร์ วิธีเขียนที่ตกลงกันเป็นสากล ให้เขียนเลขอะตอมไว้ด้านล่างซ้าย และเลขมวลไว้ด้านบนซ้ายของสัญลักษณ์
อะตอมของธาตุชนิดเดียวกันมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน แต่จำนวนนิวตรอนอาจมีได้หลายค่า ทำให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี นักเคมีชาวอังกฤษ เรียกอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่า ไอโซโทป ธาตุชนิดหนึ่งอาจมีหลายไอโซโทป บางไอโซโทปมีอยู่ในธรรมชาติและบางไอโซโทปได้จากการสังเคราะห์ เช่น ไฮโดรเจน มี 3 ไอโซโทป มีเลขมวล 1 2 และ 3 มีชื่อเฉพาะว่า โปรเทียม ดิวทีเรียม และทริเทียม ตามลำดับ ไฮโดรเจนที่เกิดในธรรมชาติมีปริมาณโปรเทียมอยู่ถึงร้อยละ 99.99 แต่ละไอโซโทปของไฮโดรเจนมีชื่อเฉพาะและใช้สัญลักษณ์แทนดังตาราง
ในปีพ.ศ.2451 รอเบิร์ต แอนดรูส์ มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยอาศัยการสังเกตหยดน้ำมันในสนามไฟฟ้า ดังรูป
การทดลองหยดน้ำมันของมิลลิแกน
ในปีพ.ศ.2429 ออยเกน โกลด์ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดและแอโนด ดังรูป
หลอดรังสีแคโทดที่ดัดแปลง
ซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่า ฉากเกิดการเรืองแสง แสดงว่ามีรังสีออกจากแอโนด ซึ่งโกลด์ชไตน์เรียกรังสีชนิดนี้ว่า รังสีแคแนล หรือรังสีแอโนด ซึ่งมีประจุบวก โกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีแอโนดมีค่าประจุต่อมวล (e/m)ไม่คงที่ จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัทเทอร์ฟอร์ดและทอมสันได้ทำการศึกษาหลอดในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจน ทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากันกับอิเล็กตรอน และหาค่ามวลของประจุบวกได้เป็น1.66 x 10-24 กรัม ซึ่งมากกว่ามวลของอิเล็กตรอนประมาณ1840 เท่า เรียกอนุภาคนี้ว่า โปรตอนในปี พ.ศ. 2475 เจมส์ แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงสูง ทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกอนุภาคนี้ว่า นิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอน การค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอม ซึ่งพบว่ามีค่ามากกว่ามวลรวมของโปรตอน เช่น ธาตุคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วย แต่มวลของอะตอมมีค่า 12 หน่วย และมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกัน ดังนั้น อิเล็กตรอน โปรตอน และนิวตรอน จึงเป็น อนุภาคในอะตอม ซึ่งอนุภาคแต่ละชนิดมีรายละเอียด ดังนี้
เลขอะตอม เลขมวล และ ไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอม และมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบนิวเคลียส อะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่น ตัวเลขที่แสดงจำนวนโปรตอนเรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมาก ดังนั้นมวลของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสที่ประกอบด้วยโปรตอนและนิวตรอน เรียกผลรวมของจำนวนโปรตอนและนิวตรอนว่า เลขมวล เช่น คาร์บอนมี 6 โปรตอนจึงมีเลขอะตอมเท่ากับ 6 โดยอาจมี 6 หรือ 7 นิวตรอน จึงมีเลขมวลเป็น 12 หรือ 13 ตามลำดับ
สัญลักษณ์ที่เขียนแสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุ เลขอะตอม และเลขมวลของอะตอม เรียกว่า สัญลักษณ์นิวเคลียร์ วิธีเขียนที่ตกลงกันเป็นสากล ให้เขียนเลขอะตอมไว้ด้านล่างซ้าย และเลขมวลไว้ด้านบนซ้ายของสัญลักษณ์
อะตอมของธาตุชนิดเดียวกันมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน แต่จำนวนนิวตรอนอาจมีได้หลายค่า ทำให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี นักเคมีชาวอังกฤษ เรียกอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่า ไอโซโทป ธาตุชนิดหนึ่งอาจมีหลายไอโซโทป บางไอโซโทปมีอยู่ในธรรมชาติและบางไอโซโทปได้จากการสังเคราะห์ เช่น ไฮโดรเจน มี 3 ไอโซโทป มีเลขมวล 1 2 และ 3 มีชื่อเฉพาะว่า โปรเทียม ดิวทีเรียม และทริเทียม ตามลำดับ ไฮโดรเจนที่เกิดในธรรมชาติมีปริมาณโปรเทียมอยู่ถึงร้อยละ 99.99 แต่ละไอโซโทปของไฮโดรเจนมีชื่อเฉพาะและใช้สัญลักษณ์แทนดังตาราง
การจัดเรียงอิเล็กตรอนในอะตอม
จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาแบบจำลองอะตอม ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบๆและอยู่ในระดับพลังงานต่างกัน อิเล็กตรอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีจำนวนอิเล็กตรอนสูงสุดเท่าใด พิจารณา ดังตาราง
จากการศึกษาแบบจำลองอะตอม ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบๆและอยู่ในระดับพลังงานต่างกัน อิเล็กตรอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีจำนวนอิเล็กตรอนสูงสุดเท่าใด พิจารณา ดังตาราง
พิจารณาข้อมูลในตารางจะพบว่า จำนวนอิเล็กตรอนในระดับพลังงานที่1 มีได้มากที่สุด 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 8 อิเล็กตรอน สำหรับระดับพลังงานที่ 3 นั้นจากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน นั่นคือ จำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ละระดับพลังงานจะมีค่าเท่ากับ2n2 เมื่อ n คือตัวเลขแสดงระดับพลังงาน
ถ้าพิจารณาตามหลัก2n2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 2 8 9 และ 2 8 10 ตามลำดับ เนื่องจากในระดับพลังงานที่ 3 ควรมีอิเล็กตรอนได้สูงสุดถึง 18 อิเล็กตรอน แต่จากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับ ซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของทั้งสองธาตุนี้มีเพียง 8 อิเล็กตรอน และอิเล็กตรอนที่เพิ่มมาอีก 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18
ระดับพลังงานหลัก และระดับพลังงานย่อย
โบร์เสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน โดยความแตกต่างของพลังงานจะมีค่าน้อยลง เมื่อมีระดับพลังงานสูงขึ้น
การอธิบายเกี่ยวกับเส้นสเปกตรัมของโบร์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความสนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสงออกมาและมองไม่เห็นเป็น 1 เส้นนั้นแท้จริงแล้วประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้น ซึ่งนำไปสู่ข้อสรุปที่ว่า เส้นสเปกตรัมที่เกิดขึ้น นอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลัก (principle energy levels หรือ shell) ซึ่งแทนด้วย n แล้ว ยังเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานย่อย (energy sublevels หรือ subshell ) ของแต่ละระดับพลังงานหลักอีกด้วย
นักวิทยาศาสตร์ได้กำหนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำดับ แนวคิดดังกล่าวนี้สามารถนำมาอธิบายสเปกตรัมของธาตุที่มีมากกว่า 1 อิเล็กตรอนได้ และจากการศึกษาเพิ่มเติมพบว่าจำนวนระดับพลังงานย่อยที่เป็นไปได้ในแต่ละระดับพลังงานหลักที่ 1-4 เป็นดังนี้
แผนภาพระดับพลังงานของอะตอมที่มีหลายอิเล็กตรอน
ระดับพลังงานหลักที่ 1 (n = 1) มี 1 ระดับพลังงานย่อย คือ s
ระดับพลังงานหลักที่ 2 (n = 2) มี 2 ระดับพลังงานย่อย คือ s p
ระดับพลังงานหลักที่ 3 (n = 3) มี 3 ระดับพลังงานย่อย คือ s p d
ระดับพลังงานหลักที่ 4 (n = 4) มี 4 ระดับพลังงานย่อย คือ s p d f
ออร์บิทัล
เนื่องจากอิเล็กตรอนมีการเคลื่อนที่ตลอดเวลา ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนจึงอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกัน บริเวณรอบนิวเคลียสซึ่งมีโอกาสจะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่า ออร์บิทัล (orbital) จากการศึกษาพบว่าจำนวนออร์บิทัลในแต่ละระดับพลังงานย่อยมีค่าแตกต่างกัน ซึ่งสามารถสรุปได้ดังนี้
ระดับพลังงานย่อย s มี 1 ออร์บิทัล
ระดับพลังงานย่อย p มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มี 7 ออร์บิทัล
แผนภาพระดับพลังงานที่แสดงจำนวนออร์บิทัล
จำนวนอิเล็กตรอนสูงสุดในออร์บิทัลที่อยู่ในระดับพลังงานย่อย s p d และ f ดังตาราง
จากตาราง จะเห็นว่าจำนวนอิเล็กตรอนสูงสุดในระดับพลังงานย่อย s p d และ f มีค่าเท่ากับ 2 6 10 และ 14 ตามลำดับ แต่เนื่องจากพลังงานย่อย s p d และ f มี 1 3 5 และ 7 ออร์บิทัลตามลำดับ แสดงว่า 1 ออร์บิทัลสามารถบรรจุอิเล็กตรอนได้ 2 อิเล็กตรอน
หลักการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอนของอะตอมหนึ่งๆให้พิจารณาตาม หลักอาฟบาว (Aufbau principle)ซึ่งเกี่ยวข้องกับระดับพลังงานของแต่ละออร์บิทัล กล่าวคือการบรรจุอิเล็กตรอนต้องบรรจุในออร์บิทัลที่มีพลังงานต่ำสุดและว่างอยู่ก่อนเสมอ นั่นคือเริ่มจาก 1s 2s 2p 3s ... ตามลำดับเพราะจะทำให้พลังงานรวมทั้งหมดมีค่าต่ำที่สุดและอะตอมมีความเสถียรที่สุด1s1
แผนภาพแสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัลต่างๆ
จากแผนภาพสามารถเรียงลำดับพลังงานได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ...
ไฮโดรเจนอะตอมซึ่งมี 1 อิเล็กตรอน สามารถเขียนสัญลักษณ์แสดงการจัดเรียงได้เป็น โดยมีความหมายดังนี้
สัญลักษณ์การจัดเรียงอิเล็กตรอนของไฮโดรเจนอะตอม
สำหรับธาตุNa Mg Al Si P S Cl Ar K และ Ca ซึ่งมีอิเล็กตรอน 11 12 13 14 15 16 17 18 19 และ 20 ตามลำดับ สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนแบบเต็มและแบบย่อโดยเขียนแก๊สมีสกุลในวงเล็บแทนการจัดเรียงอิเล็กตรอนของแก๊สมีสกุลในชั้นถัดไปและแสดงการจัดเรียงอิเล็กตรอนเฉพาะชั้นนอกสุด ดังตาราง
การบรรจุอิเล็กตรอนตามลำดับระดับพลังงานโดยการอาศัยแผนภาพตามหลักอาฟบาวดังที่กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่เป็นไปตามหลักการนั้นเช่น ธาตุ Cr เลขอะตอม 24 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่างๆได้ ดังนี้
1s2 2s2 2p6 3s2 3p6 3d5 4s1 2, 8, 13, 1
1.กรณีที่ธาตุได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลักอาฟบาว เช่น
Cl - มีประจุลบ 1 แสดงว่า อะตอมของ Cl รับอิเล็กตรอนมา 1 ตัว
O 2- มีประจุลบ 2 แสดงว่า อะตอมของ O รับอิเล็กตรอนมา 2 ตัว
N 3- มีประจุลบ 3 แสดงว่า อะตอมของ N รับอิเล็กตรอนมา 3 ตัว
2.กรณีที่ธาตุเสียอิเล็กตรอน ให้บรรจุอิเล็กตรอนตามปกติก่อน จากนั้นจึงนำอิเล็กตรอนที่อยู่ชั้นนอกสุดออก เช่น
Na + มีประจุบวก 1 แสดงว่า อะตอมของ Na สูญเสียอิเล็กตรอนไป 1 ตัว
Mg2+ มีประจุบวก 2 แสดงว่า อะตอมของ Mg สูญเสียอิเล็กตรอนไป 2 ตัว
Al 3+ มีประจุบวก 3 แสดงว่า อะตอมของ Al สูญเสียอิเล็กตรอนไป 3 ตัว
Mg2+ มีประจุบวก 2 แสดงว่า อะตอมของ Mg สูญเสียอิเล็กตรอนไป 2 ตัว
Al 3+ มีประจุบวก 3 แสดงว่า อะตอมของ Al สูญเสียอิเล็กตรอนไป 3 ตัว
ตารางธาตุและสมบัติของธาตุหมู่หลัก
วิวัฒนาการของการสร้างตารางธาตุ
เมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุต่างๆเหล่านี้แล้ว นักวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆของธาตุและนำมาใช้จัดธาตุเป็นกลุ่มได้หลายแบบ ในปี พ.ศ. 2360 โยฮันน์ โวล์ฟกัง เดอเบอไรเนอร์ (Johann Wolfgang Dobereiner) เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม (triads) โดยพบว่าธาตุกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ แต่เมื่อนำหลักของชุดสามไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน พบว่าค่ามวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของสองธาตุที่เหลือ หลักชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับในเวลาต่อมา
ในปีพ.ศ. 2407 จอห์น นิวแลนด์ (John Newlands) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอกฎในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมาก พบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ (ไม่รวมธาตุไฮโดรเจนและแก๊สมีสกุล) เช่น เริ่มต้นเรียงโดยใช้ธาตุ Li เป็นธาตุที่ 1 ธาตุที่ 8 จะเป็น Na ซึ่งมีสมบัติคล้ายธาตุ Li ดังตัวอย่างการจัดต่อไปนี้
ธาตุกลุ่ม s และกลุ่ม p เรียกรวมกันว่า ธาตุกลุ่ม A ซึ่งเป็นธาตุเรพรีเซนเททีฟ (representtative element) หรืออาจเรียกว่ากลุ่มธาตุหมู่หลัก (main group element) เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่ม A พบว่าธาตุในแนวตั้งที่อยู่ในกลุ่ม A จะมีเวเลนซ์อิเล็กตรอนเท่ากันและจำนวนเวเลนซ์อิเล็กตรอนจะตรงกับเลขหมู่ สำหรับธาตุตามแนวนอนที่อยู่ในคาบเดียวกัน พบว่ามีจำนวนระดับพลังงานเท่ากัน และจำนวนระดับพลังงานจะตรงกับเลขที่คาบ
ธาตุบางหมู่มีการกำหนดชื่อที่เป็นสากล เช่น
-ธาตุหมู่ IA เรียกว่า โลหะแอลคาไล (alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
-ธาตุหมู่ IIA เรียกว่า โลหะแอลคาไลน์เอิร์ท (alkaline earth) ได้แก่ Be Mg Ca Sr Ba Ra
-ธาตุหมู่ VIIA เรียกว่า ธาตุแฮโลเจน (halogen) ได้แก่ F Cl Br I At
-ธาตุหมู่ที่ VIIIA เรียกว่า แก๊สมีสกุล (Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
ธาตุกลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือกลุ่มธาตุทรานซิชัน (transition element) ซึ่งแบ่งเป็น ธาตุทรานซิชันชั้นนอก (outer transition) ได้แก่ธาตุกลุ่ม d และธาตุทรานซิชันชั้นใน (inner transition) ได้แก่ธาตุกลุ่ม f โดยธาตุกลุ่ม f ยังแบ่งได้เป็น 2กลุ่มย่อย
ประกอบด้วยแลนทานอยด์ และ แอกทินอยด์
ขนาดอะตอมตามแบบจำลองอะตอมแบบกลุ่มหมอก อิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้ นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดี่ยวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกัน จึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในภาวะอิสระหรือเป็นอะตอมเดี่ยว ในทางปฏิบัติจึงบอกขนาดอะตอมด้วย รัศมีอะตอม ซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน การศึกษารัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ ตัวอย่างรัศมีอะตอมของธาตุ ดังตาราง
พิจารณาขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันพบว่า ขนาดอะตอมมีแนวโน้มลดลงเมื่อเลขอะตอมเพิ่มขึ้น อธิบายได้ว่า เนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกัน แต่มีจำนวนโปรตอนในนิวเคลียสแตกต่างกัน ธาตุที่มีจำนวนโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนด้วยแรงที่มากกว่าธาตุที่มีจำนวนโปรตอนน้อย เวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่าทำให้อะตอมมีขนาดเล็กลง ส่วนธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นจำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีอิเล็กตรอนเพิ่มขึ้นด้วย อิเล็กตรอนที่อยู่ชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอน ทำให้แรงดึงดูดต่อเวเลนซ์อิเล็กตรอนมีน้อย เป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเข้ามาหรือเสียอิเล็กตรอนออกไปจะกลายเป็นไอออน การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสขนาไอออนคู่หนึ่งๆ ที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก ตัวอย่าง
เมื่อโลหะทำปฏิกิริยากับอโลหะ อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก จำนวนอิเล็กตรอนในอะตอมจึงลดลง ทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วย หรือกล่าวอีกนัยก็คือแรงดึงดูดระหว่างประจุในนิวเคลียสกับอิเล็กตรอนจะเพิ่มมากขึ้น ไอออนบวกจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบ เนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอน ขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิม ไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม ตัวอย่างขนาดอะตอมและขนาดไอออนของธาตุ
อิเล็กโทรเนกาวิตี
เมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุต่างๆเหล่านี้แล้ว นักวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆของธาตุและนำมาใช้จัดธาตุเป็นกลุ่มได้หลายแบบ ในปี พ.ศ. 2360 โยฮันน์ โวล์ฟกัง เดอเบอไรเนอร์ (Johann Wolfgang Dobereiner) เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม (triads) โดยพบว่าธาตุกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ แต่เมื่อนำหลักของชุดสามไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน พบว่าค่ามวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของสองธาตุที่เหลือ หลักชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับในเวลาต่อมา
ในปีพ.ศ. 2407 จอห์น นิวแลนด์ (John Newlands) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอกฎในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมาก พบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ (ไม่รวมธาตุไฮโดรเจนและแก๊สมีสกุล) เช่น เริ่มต้นเรียงโดยใช้ธาตุ Li เป็นธาตุที่ 1 ธาตุที่ 8 จะเป็น Na ซึ่งมีสมบัติคล้ายธาตุ Li ดังตัวอย่างการจัดต่อไปนี้
การจัดเรียงธาตุตามแนวคิดของนิวแลนด์ใช้ได้ถึงธาตุแคลเซียมเท่านั้นกฎนี้ไม่สามารถอธิบายได้ว่าเพราะเหตุใดมวลอะตอม
จึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุทำให้ไม่เป็นที่ยอมรับในเวลาต่อมา
ในปีพ.ศ. 2412 ยูลิอุส โลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมันและดิมิทรี เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซีย ได้ศึกษารายละเอียดของธาตุต่างๆมากขึ้นทำให้มีข้อสังเกตว่าถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมากจะพบว่าธาตุมีสมบัติคล้ายกันเป็นช่วงๆการที่ธาตุต่างๆมีสมบัติคล้ายกันเป็นช่วงเช่นนี้เมนเดเลเอฟตั้งเป็นกฎเรียกว่า กฎพิริออดิก (periodic law) และได้เสนอความคิดนี้ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะเผยแพร่ผลงานของเขาหนึ่งปีเพื่อเป็นการให้เกียรติแก่เมนเด เลเอฟ จึงเรียกตารางนี้ว่า ตารางพิริออดิกของเมนเดเลเอฟ ในปีต่อมาเมนเดเลเอฟได้ปรับปรุงตารางธาตุใหม่
อย่างไรก็ตามเมนเดเลเอฟไม่สามารถอธิบายได้ว่าเพราะเหตุใดจึงต้องจัดเรียงธาตุตามมวลอะตอม เนื่องจากสมัยนั้นนักวิทยาศาสตร์ยังศึกษาโครงสร้างของอะตอมและไอโซโทปได้ไม่ชัดเจน
นักวิทยาศาสตร์รุ่นต่อมาเกิดแนวความคิดว่าตำแหน่งของธาตุในตารางธาตุไม่น่าจะขึ้นอยู่กับมวลอะตอมของธาตุแต่น่าจะขึ้นอยู่กับสมบัติอื่นที่มีความสัมพันธ์กับมวลอะตอม
ในปีพ.ศ. 2456 เฮนรี โมสลีย์ นักวิทยาศาสตร์ชาวอังกฤษ ได้เสนอให้จัดธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่างๆ ของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุในปัจจุบันจึงได้จัดเรียงธาตุตามเลขอะตอมจากน้อยไปมากซึ่งสอดคล้อง กับกฎพิริออดิกที่ได้กล่าวมาแล้ว
ตารางธาตุที่นิยมใช้ในปัจจุบันได้ปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามลำดับเลขอะตอมแทนการเรียงตามมวลอะตอม
ตารางธาตุที่นิยมใช้ในปัจจุบันได้ปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามลำดับเลขอะตอมแทนการเรียงตามมวลอะตอม
ตารางธาตุในปัจจุบัน
ตารางธาตุแบ่งธาตุในแนวตั้งเป็น 18 แถว โดยเรียกแถวในแนวตั้งว่า หมู่ และแบ่งธาตุในแนวนอนเป็น 7 แถว เรียกแถวในแนวนอนว่า คาบ ซึ่งแต่ละคาบจัดเรียงธาตุตามเลขอะตอมที่เพิ่มขึ้นตามลำดับ
กลุ่มของธาตุในตารางธาตุ
การที่นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของธาตุต่างๆ ถ้าแบ่งกลุ่มธาตุตามสมบัติความเป็นโลหะจะแบ่งได้เป็น 3 กลุ่ม คือ ธาตุโลหะ เป็นธาตุที่นำไฟฟ้าและนำความร้อนได้ดี ธาตุกึ่งโลหะ เป็นธาตุนำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้องแต่นำไฟฟ้าได้ดีขึ้นเมื่ออุณหภูมิสูงขึ้น และ ธาตุอโลหะ ซึ่งไม่นำไฟฟ้า ยกเว้นคาร์บอน (แกรไฟต์) และฟอสฟอรัสดำ ตำแหน่งของธาตุในตารางธาตุพบว่า ธาตุโลหะอยู่ทางด้านซ้ายมือของตารางธาตุ
ธาตุกึ่งโลหะอยู่บริเวณที่เป็นขั้นบันได และธาตุอโลหะอยู่ขวามือของตารางธาตุ ยกเว้นไฮโดรเจนอยู่ทางด้านซ้ายมือของตารางธาตุ
ถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอนในออร์บิทัล s p d และ f ที่มีพลังงานสูงสุดและมีอิเล็กตรอนบรรจุอยู่ จะแบ่งธาตุออกเป็น 4 กลุ่มใหญ่คือ ธาตุกลุ่ม s ได้แก่ธาตุในหมู่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ธาตุในหมู่ 13ถึง 18 ยกเว้น He ธาตุกลุ่ม d ได้แก่ ธาตุในหมู่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่ กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่แยกมาจากหมู่ 3 คาบที่ 6 และ 7 ดังรูป
ตำแหน่งของธาตุตามระดับพลังงานย่อย
ธาตุบางหมู่มีการกำหนดชื่อที่เป็นสากล เช่น
-ธาตุหมู่ IA เรียกว่า โลหะแอลคาไล (alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
-ธาตุหมู่ IIA เรียกว่า โลหะแอลคาไลน์เอิร์ท (alkaline earth) ได้แก่ Be Mg Ca Sr Ba Ra
-ธาตุหมู่ VIIA เรียกว่า ธาตุแฮโลเจน (halogen) ได้แก่ F Cl Br I At
-ธาตุหมู่ที่ VIIIA เรียกว่า แก๊สมีสกุล (Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
ธาตุกลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือกลุ่มธาตุทรานซิชัน (transition element) ซึ่งแบ่งเป็น ธาตุทรานซิชันชั้นนอก (outer transition) ได้แก่ธาตุกลุ่ม d และธาตุทรานซิชันชั้นใน (inner transition) ได้แก่ธาตุกลุ่ม f โดยธาตุกลุ่ม f ยังแบ่งได้เป็น 2กลุ่มย่อย
ประกอบด้วยแลนทานอยด์ และ แอกทินอยด์
ขนาดอะตอมตามแบบจำลองอะตอมแบบกลุ่มหมอก อิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้ นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดี่ยวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกัน จึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในภาวะอิสระหรือเป็นอะตอมเดี่ยว ในทางปฏิบัติจึงบอกขนาดอะตอมด้วย รัศมีอะตอม ซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน การศึกษารัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ ตัวอย่างรัศมีอะตอมของธาตุ ดังตาราง
รัศมีอะตอม (พิโกเมตร) ของธาตุบางชนิด
ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเข้ามาหรือเสียอิเล็กตรอนออกไปจะกลายเป็นไอออน การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสขนาไอออนคู่หนึ่งๆ ที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก ตัวอย่าง
รัศมีอะตอมและรัศมีไอออน (พิโกเมตร)ของธาตุบางชนิด
เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ ส่วนใหญ่มีแนวโน้มมีขนาดเพิ่มขึ้นจากบนลงล่างเช่นเดียวกับขนาดอะตอม รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอม แต่รัศมีไอออนลบจะมีค่ามากกว่ารัศมีอะตอม
พลังงานไอออไนเซชัน
พลังงานไอออไนเซชัน (IE) คือค่าพลังงาน ที่ใช้ในการดึงให้อิเล็กตรอนวงนอกสุด (เวเลนซ์อิเล็กตรอน)หลุดออกจากอะตอมหรือโมเลกุลที่อยู่ในสถานะก๊าซปริมาณพลังงานที่น้อยที่สุดที่สามารถทำให้อะตอมหรือโมเลกุลปลดปล่อยอิเล็กตรอน ค่าพลังงานไอออไนเซชันจะบ่งบอกว่าอะตอมหรือไอออนนั้นสามารถเสียอิเล็กตรอนได้ง่ายหรือยาก หรือในอีกมุมหนึ่งเป็นการบ่งบอกระดับพลังงานของอิเล็กตรอนวงนอกสุดของอะตอมหรือไอออนนั้นว่ามีความเสถียรมากเพียงใด โดยทั่วไปค่าพลังงานไอออไนเซชันจะมีค่าเพิ่มขึ้นเมื่อพยายามที่จะทำให้อิเล็กตรอนตัวต่อไปถูกปลดปล่อยออกมา เนื่องจากการผลักกันของประจุอิเล็กตรอนมีค่าลดลงและการกำบังของอิเล็กตรอนชั้นวงในมีค่าลดลง ซึ่งทำให้แรงดึงดูดระหว่างนิวเคลียสและอิเล็กตรอนมีค่ามาขึ้น อย่างไรก็ตามค่าที่เพิ่มขึ้นอาจไม่เพิ่มเท่าที่ควรจะเป็นในกรณีที่เมื่อปลดปล่อยอิเล็กตรอนตัวนั้นแล้วส่งผลให้เกิดการบรรจุเต็มหรือการบรรจุครึ่งในระดับชั้นพลังงาน เนื่องจากทั้งสองกรณีมีเสถียรภาพเป็นพิเศษ
กระบวนการสูญเสียอิเล็กตรอนนี้เกิดได้หลายครั้งสำหรับอะตอมหรือโมเลกุลที่มีหลายอิเล็กตรอน จึงเรียกเป็น IE1 IE2 IE3 ... ตามลำดับซึ่งก็คือค่าพลังงานในการดึงอิเล็กตรอนตัวที่ 1 2 3 ... นั่นเอง โดยอิเล็กตรอนตัวแรกย่อมจะหลุดออกไปง่ายกว่าอิเล็กตรอนลำดับถัดๆไปเสมอ พลังงานที่ต้องใช้จึงเพิ่มขึ้น
ค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุบางชนิด
การศึกษาแนวโน้มของค่าพลังงานไอออนไนเซชันของอะตอมหรือโมเลกุลนั้น สามารถช่วยนักวิทยาศาสตร์ทำความเข้าใจโครงสร้างของอิเล็กตรอนภายในอะตอมและโมเลกุลได้ดีขึ้น หากค่าพลังงานไอออไนเซชันเพิ่มขึ้นเป็นเส้นตรงอาจกล่าวได้ว่าอิเล็กตรอนเหล่านั้นมาจากชั้นอิเล็กตรอนเดียวกัน แต่ถ้าพบว่าค่าพลังงานไอออไนเซชันกระโดดไปก็หมายความว่าอิเล็กตรอนที่หลุดออกมานั้นอยู่ในชั้นที่ลึกเข้าไปอีก นอกจากนี้พลังงานไอออไนเซชันยังเป็นแนวโน้มตามตารางธาตุอย่างหนึ่งที่มีลักษณะชัดเจนและสามารถอธิบายได้โดยโครงสร้างการจัดเรียงอิเล็กตรอนของอะตอม
สัมพรรคภาพอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอน (electron affinity : EA) หมายถึงพลังงานที่อะตอมในสถานะแก๊สคายออกเมื่ออะตอมได้รับอิเล็กตรอน 1 อิเล็กตรอน ซึ่งเขียนสมการแสดงการเปลี่ยนแปลงพลังงานได้ดังนี้
A(g) + e– A–(g) + DE
EA มีค่าเป็นลบ (–) เนื่องจากมีการคายพลังงานออกมา แสดงว่าอะตอมนั้นมีแนวโน้มที่จะรับอิเล็กตรอนเข้ามาได้ดี ความสามารถในการรับอิเล็กตรอนของแต่ละธาตุมีความแตกต่างกัน ดังตัวอย่าง
F(g) + e– F– (g) EA = –333 kJ/mol
O(g) + e– O– (g) EA = –142 kJ/mol
P(g) + e– P– (g) EA = –74 kJ/mol
จากตัวอย่างแสดงว่า F มีแนวโน้มรับอิเล็กตรอนได้สูงกว่า O และ P ตามลำดับ เมื่ออะตอมของธาตุรับ 1 อิเล็กตรอนแล้ว การรับอิเล็กตรอนเพิ่มขึ้นอีก 1 อิเล็กตรอนจะรับได้ยากขึ้น ดังนั้นค่า EA จึงมีค่าสูงขึ้นจนเป็นบวกได้ เช่น
O–(g) + e– O2–(g) EA = 780 kJ/mol
โลหะมีแนวโน้มที่จะเสียอิเล็กตรอน โดยทั่วไปค่า EA ของโลหะจึงมีค่าเป็นลบน้อย ๆ ถึงค่าบวกน้อย ๆ ดังตาราง
ค่าสัมพรรคภาพอิเล็กตรอนของธาตุบางชนิด
เมื่อพิจารณาตามคาบพบว่า ค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะ (ยกเว้นหมู่ VIIA) มีค่ามากกว่าธาตุโลหะ แสดงว่าธาตุอโลหะมีแนวโน้มที่จะรับอิเล็กตรอนได้ดีกว่าธาตุโลหะ เมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าธาตุหมู่อื่น ที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้อะตอมมีการจัดเรียงอิเล็กตรอนเหมือนธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
อิเล็กโทรเนกาติวิตี (electronegativity : EN) หมายถึงค่าที่แสดงความสามารถในการดึงดูดอิเล็กตรอนของอะตอมคู่ที่เกิดพันธะที่จะรวมกันเป็นโมเลกุล ธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงจะมีความสามารถในการดึงดูดหรือรับอิเล็กตรอนได้ดี ได้แก่พวกอโลหะ ส่วนธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำจะดึงดูดหรือรับอิเล็กตรอนได้ไม่ดี ได้แก่พวกโลหะ เช่น โมเลกุลของ HCl เนื่องจาก Cl ดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น Cl จึงมีค่าอิเล็กโทรเนกาติวิตีสูงกว่า H แนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุเป็นดังนี้
ค่าอิเล็กโทรเนกาติวิตีของธาตุบางชนิด
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่า มีแนวโน้มเพิ่มขึ้นตามเลขอะตอม เนื่องจากในคาบเดียวกัน อะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุด และหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอิเล็กตรอนตามคาบจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุด ส่วนธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุด ธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตีลดลงเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง





























ไม่มีความคิดเห็น:
แสดงความคิดเห็น